🔗 Hwang, E. J., et al. (2025). Accuracy of Fully Automated and Human-assisted AI-based CT Quantification of Pleural Effusion Changes after Thoracentesis. DOI: 10.1148/ryai.240215.
📌 Resumo e Questões Estimulantes
Resumo
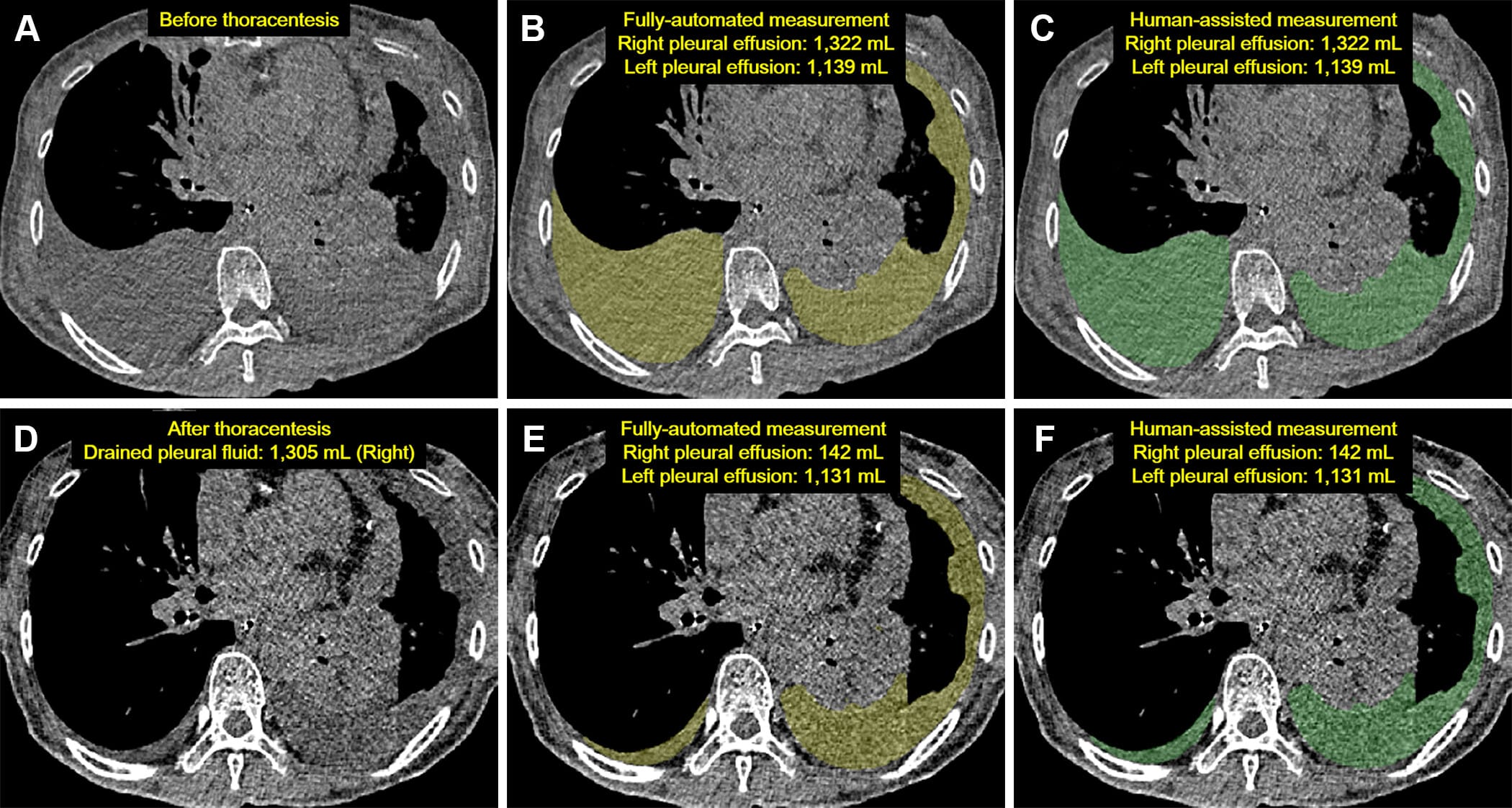
Este estudo avaliou a precisão na quantificação do volume de derrame pleural por IA em tomografias computadorizadas (CT) antes e depois da toracocentese. Foram comparadas duas abordagens: totalmente automatizada e assistida por humanos, utilizando o volume de fluido drenado como referência.
✅ Resultados principais:
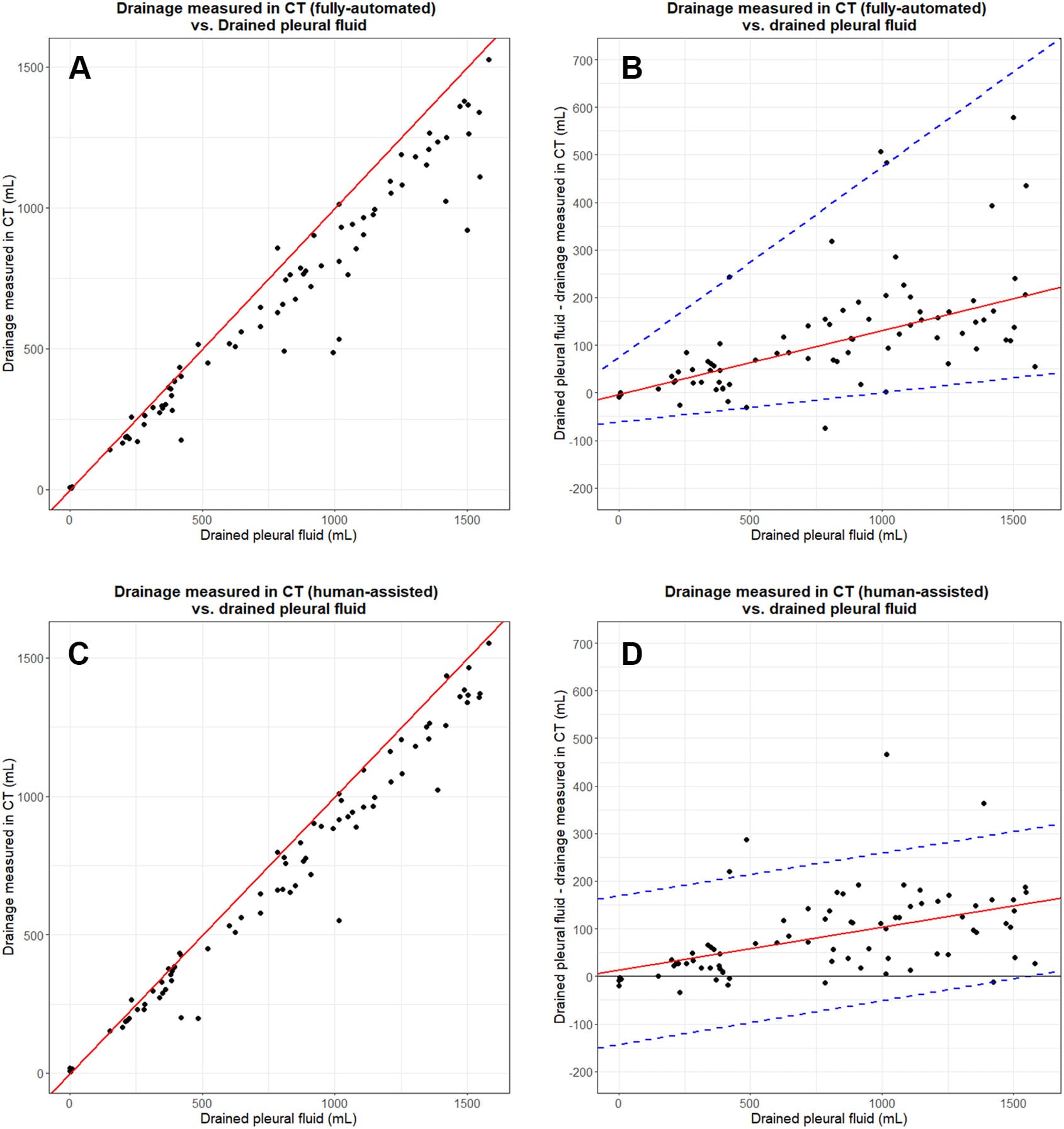
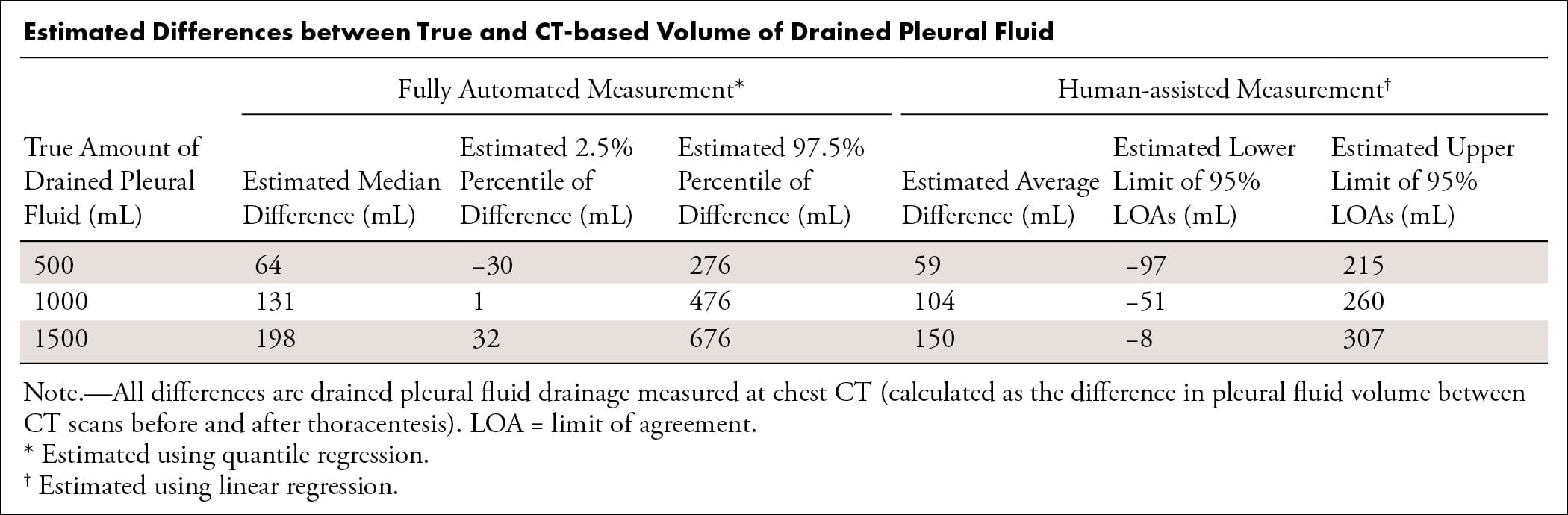
- Ambos os métodos subestimaram o volume real drenado.
- Erro médio da IA automatizada: 13,1% (~131 mL para 1L drenado).
- Erro médio da IA assistida: 10,9% (~104 mL para 1L drenado).
- Correlação excelente (ICC > 0.99) entre IA e medições manuais.
Questões Estimulantes
- Como a IA pode melhorar a precisão da quantificação de fluidos pleurais na tomografia?
- A quantificação automatizada pode substituir a avaliação manual de radiologistas?
- Quais são os desafios técnicos para reduzir a subestimação nos cálculos da IA?
🗝️ Descomplicando os Conceitos Principais
Introdução
A quantificação do volume de derrame pleural na tomografia computadorizada é crítica para guiar decisões terapêuticas. Métodos tradicionais baseiam-se na avaliação visual, que pode ser subjetiva e variar entre especialistas.
Dimensões do Tema
- Derrame Pleural: Acúmulo anormal de líquido na cavidade pleural.
- Toracocentese: Procedimento para drenagem desse fluido.
- Inteligência Artificial: Algoritmos de segmentação podem quantificar automaticamente o volume de fluido.
Considerações Práticas
| Aspecto | Descrição |
|---|---|
| Amostra do estudo | 79 pacientes submetidos a toracocentese |
| Tecnologia utilizada | IA baseada em segmentação volumétrica no software MEDIP PRO |
| Métodos avaliados | IA totalmente automatizada vs. IA com revisão manual |
| Precisão dos métodos | IA automatizada: erro de 13,1% IA assistida: erro de 10,9% |
Imagens e Tabela do Artigo
Integração Prática
- Aplicação clínica: Reduz o tempo de análise de imagens.
- Limitações: Pequena subestimação do volume drenado ainda precisa ser corrigida.
- Uso em hospitais: IA pode auxiliar radiologistas na quantificação objetiva do volume de derrame.
Direções Futuras
- Treinamento com novos dados: Melhorar segmentação com dados de maior diversidade.
- Combinação IA + Radiologista: Modelos híbridos podem garantir maior precisão.
- Validação em larga escala: Testes adicionais para otimizar a adoção clínica.
🆚 Análise Comparativa com Fontes Externas
| Critério | Artigo Principal (Hwang et al., 2025) | Artigos Externos |
|---|---|---|
| Subestimação do volume | Subestimação de 13,1% (automatizado) e 10,9% (assistido) em relação ao volume drenado real. | Kim et al. (2024): Não aborda volume, mas relata 89% de acurácia em diagnóstico diferencial (DOI). |
| Acurácia diagnóstica | Foco em quantificação, não diagnóstico. ICC >0,99 para confiabilidade técnica. | Ozcelik et al. (2023): Acurácia de 94% para derrames malignos usando CNN (DOI). |
| Impacto do tipo de fluido | Maior erro em derrames malignos/sanguinolentos (Tabela S3). | Wang et al. (2021): Modelo de IA diferencia maligno/benigno com AUC 0,96, mas não quantifica volume (DOI). |
| Confiabilidade (ICC) | ICC 0,99 entre métodos automático e humano. | Li et al. (2021): Framework “driverless” atinge AUC 0,93 para malignidade, mas sem análise de confiabilidade (DOI). |
| Aplicação clínica | Alerta para erros sistemáticos em grandes volumes (>500 mL). | Ren et al. (2019): Modelo para TB pleural com 87% de sensibilidade, mas sem avaliação de volume (DOI). |
❌ Fact Check
Claim 1: “A subestimação aumenta proporcionalmente ao volume drenado.”
✅ Fato: Confirmado por Hwang et al. (β = 0,82; P < 0,001) e Li et al. (2021), que identificaram viés em grandes volumes (DOI).
Claim 2: “A IA tem excelente confiabilidade (ICC >0,99).”
⚠️ Contexto: ICC alto reflete consistência, não precisão absoluta. Wang et al. (2021) também reportam alta confiabilidade (AUC 0,96), mas apenas para diagnóstico (DOI).
Claim 3: “Derrames malignos têm maior erro de quantificação.”
✅ Fato: Correlaciona-se com Ozcelik et al. (2023), que observaram maior complexidade em derrames malignos devido a heterogeneidade (DOI).
Claim 4: “Ajustes manuais reduzem erros significativamente.”
❌ Relativo: Redução de 13,1% para 10,9% é modesta. Ren et al. (2019) mostraram que ajustes em algoritmos melhoram diagnósticos (DOI), mas não resolvem viés sistêmico.
🔍 Perspective Research Revisado
- Ren et al. (2019)
Identifying tuberculous effusion (DOI)
Lição: Métodos híbridos (IA + ajustes clínicos) são essenciais, como no uso de radiologistas no estudo principal. - Kim et al. (2024)
Differential Diagnosis of Pleural Effusion Using Machine Learning (DOI)
Relevância: Complementa o estudo principal ao demonstrar que IA é mais madura para diagnóstico qualitativo (89% acurácia) do que para quantificação volumétrica. - Ozcelik et al. (2023)
Deep learning for diagnosis of malign pleural effusion (DOI)
Conexão: Explica por que derrames malignos têm maior erro no estudo principal: imagens complexas exigem redes neurais especializadas. - Wang et al. (2021)
Differentiation of malignant from benign effusions (DOI)
Contraste: Enquanto Hwang et al. focam em erro quantitativo, este artigo destaca o potencial da IA para reduzir erros qualitativos (AUC 0,96). - Li et al. (2021)
Driverless AI framework for malignant effusion (DOI)
Sugestão: Propõe automação total, mas o estudo principal alerta para riscos sem supervisão humana.
📋 FAQ: Perguntas Frequentes
- A IA pode substituir totalmente a análise de imagens médicas?
- Não. A IA auxilia, mas a revisão humana ainda é necessária em muitos casos.
- Os algoritmos de segmentação são precisos?
- Sim, com correlações acima de 0.99, mas pequenos erros persistem.
- Como melhorar a precisão dos modelos IA?
- Treinamento em bases de dados mais amplas e melhoria dos algoritmos de segmentação.