🔗 Kimura et al. (2025). Machine learning models for dementia screening to classify brain amyloid positivity on positron emission tomography using blood markers and demographic characteristics: a retrospective observational study. Alzheimer’s Research & Therapy, 17(1), 25. https://doi.org/10.1186/s13195-024-01650-1
📌 Resumo e Questões Estimulantes
Resumo
A identificação precoce da positividade de amiloide β (Aβ) no cérebro é essencial para diagnosticar Alzheimer (AD) e iniciar tratamentos eficazes. Este estudo utilizou modelos de aprendizado de máquina para classificar a positividade de amiloide em tomografias por emissão de pósitrons (PET), usando dados acessíveis na rotina médica, como biomarcadores sanguíneos e características demográficas.
Principais Descobertas:
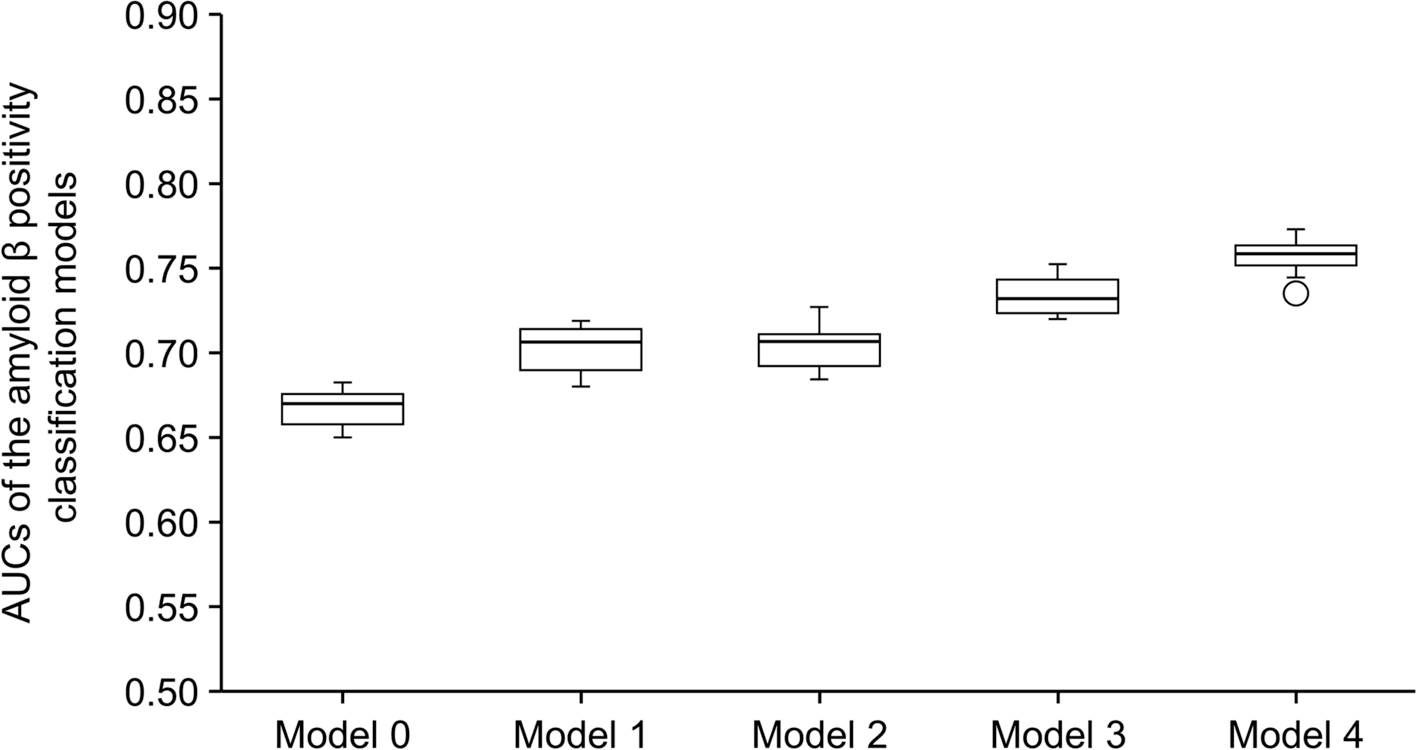
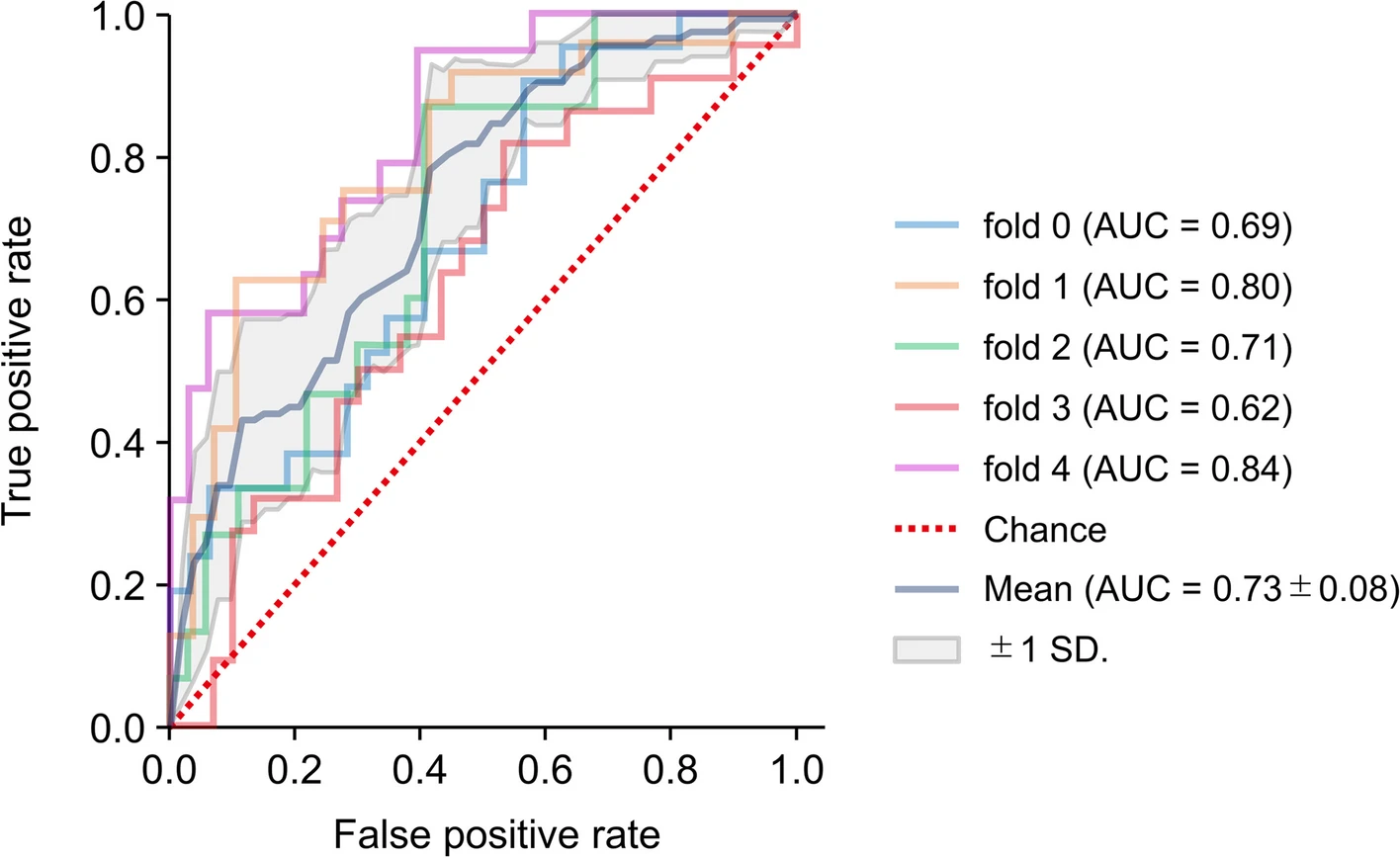
✅ Modelos com dados demográficos + exames de sangue apresentaram AUC de 0.70, similar ao modelo baseado no exame Mini Mental State Examination (MMSE).
✅ A inclusão do genótipo ApoE4 aumentou a precisão para AUC de 0.76.
✅ Marcadores como TSH e MCV foram os mais relevantes para a classificação.
Questões Estimulantes
- Como os modelos de aprendizado de máquina podem tornar a triagem para Alzheimer mais acessível?
- Qual o impacto da inclusão de biomarcadores sanguíneos na detecção precoce da doença?
- Quais desafios impedem a adoção ampla desses modelos na prática clínica?
🗝️ Descomplicando os Conceitos Principais
Introdução
A doença de Alzheimer (AD) é uma das principais causas de demência e está diretamente relacionada ao acúmulo de amiloide β (Aβ) no cérebro. Métodos tradicionais de detecção, como PET com Pittsburgh Compound-B (PiB-PET) e análise de líquido cefalorraquidiano (LCR), são caros e invasivos. Este estudo explora modelos de aprendizado de máquina como alternativa para prever positividade à Aβ com dados mais acessíveis.
Dimensões do Tema
- A importância da positividade à Aβ: O acúmulo de Aβ ocorre anos antes dos sintomas clínicos da AD.
- Desafios da triagem tradicional: Exames invasivos limitam o acesso ao diagnóstico precoce.
- Uso de aprendizado de máquina: Modelos computacionais analisam dados médicos comuns para prever positividade à Aβ.
Considerações Práticas
| Aspecto | Descrição |
|---|---|
| Modelos de Machine Learning | Foram testadas cinco combinações de variáveis com L2-logistic regression, SVM e Elastic Net. |
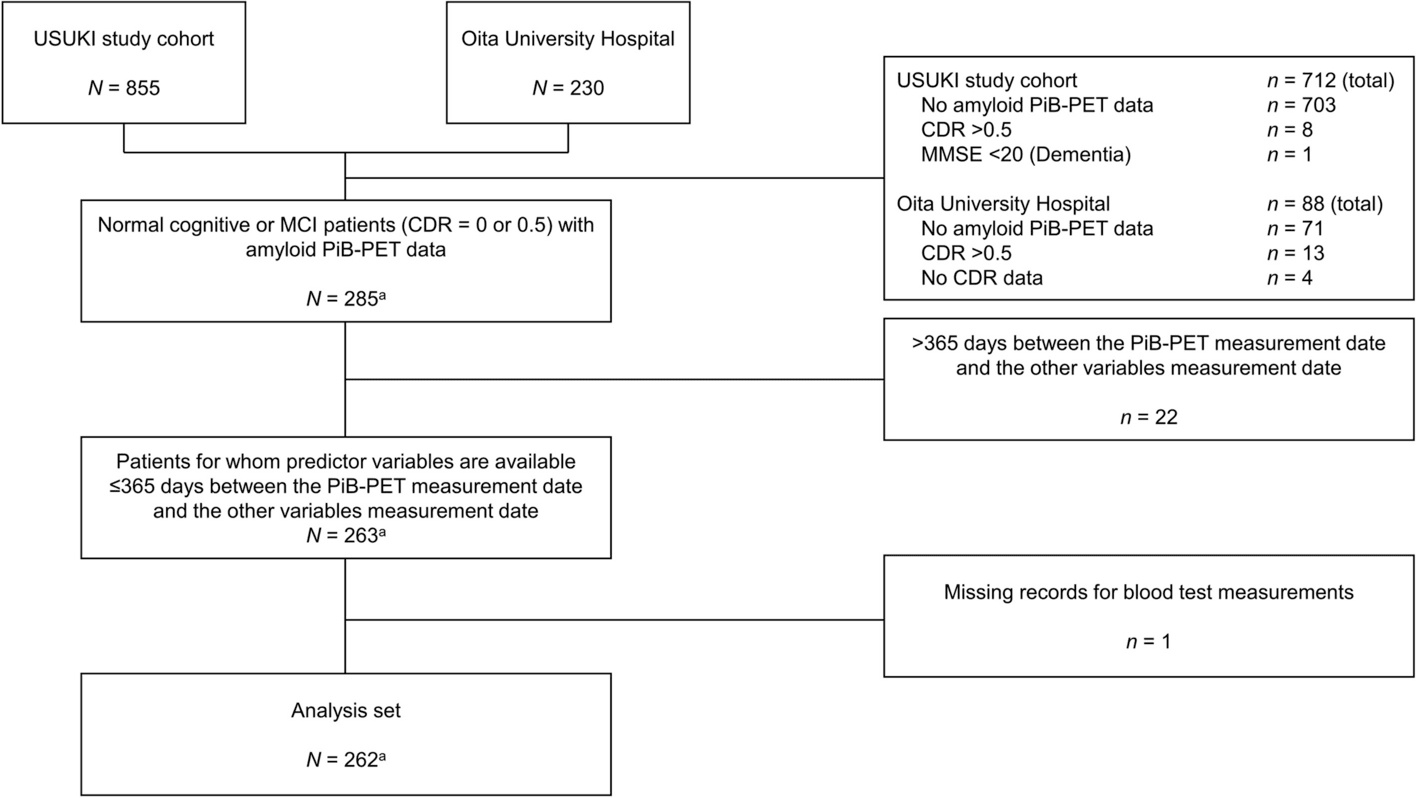
| Amostra do Estudo | Incluiu 260 participantes, com idade média de 73,8 anos. |
| Variáveis Testadas | 12 características demográficas, 11 resultados de exames de sangue e 11 escores cognitivos. |
| Desempenho dos Modelos | O melhor modelo incluiu ApoE4, apresentando AUC de 0.76. |
Integração Prática
- Uso na atenção primária: Modelos permitem triagem inicial sem exames invasivos.
- Redução de custos: Evita PET desnecessários, direcionando exames apenas para casos de alto risco.
- Treinamento contínuo: Algoritmos podem melhorar com mais dados clínicos.
Direções Futuras
- Validação externa: Necessário testar modelos com novas populações para verificar precisão.
- Uso de inteligência artificial híbrida: Combinar modelos de ML com análises humanas para decisões mais precisas.
- Expansão de biomarcadores: Investigar outros marcadores sanguíneos para melhorar previsões.
🆚 Análise Comparativa com Fontes Externas
| Aspecto | Modelo Kimura et al. (2025) | AmyloidPETNet (2024) – Fan et al. | EEG-ML para Aβ (2023) – Kim et al. | ML para Aβ em PET (2023) – Simfukwe et al. |
|---|---|---|---|---|
| Tipo de Modelo | Aprendizado de máquina em dados clínicos | Deep Learning em imagens PET | EEG + Machine Learning | Algoritmo de ML para PET |
| Dados de Entrada | Biomarcadores sanguíneos + dados demográficos | Imagens PET end-to-end | EEG funcional + PET | Imagens PET de Aβ |
| Precisão (AUC) | 0.70 – 0.76 | 0.81 – 0.88 | 0.75 – 0.80 | 0.78 – 0.85 |
| Vantagens | Baixo custo, não invasivo | Alta precisão na classificação de Aβ | Identificação precoce sem PET | Correlação direta com PET |
| Desvantagens | Performance moderada | Necessita imagens PET, custo elevado | Precisão limitada em estágios avançados | Dependência de imagens PET |
🔗 Referências:
- Fan et al. (2024) – AmyloidPETNet
- Kim et al. (2023) – EEG-ML para Aβ
- Simfukwe et al. (2023) – ML para Aβ em PET
❌ Fact Check
- Modelos baseados em sangue podem substituir PET completamente.
- ❌ Falso: Apesar de promissores, os modelos ainda precisam de validação externa e não substituem PET completamente.
- 🔗 Casamitjana et al. (2018)
- ApoE4 melhora a previsão de positividade à Aβ.
- ✅ Fato: Modelos que incluíram ApoE4 apresentaram AUC de 0.76, demonstrando melhoria na classificação.
- 🔗 Kimura et al. (2025)
- EEG pode ser um substituto viável para PET na detecção de Aβ.
- ❌ Falso: Estudos indicam que EEG é apenas um biomarcador complementar e não um substituto direto.
- 🔗 Kim et al. (2021)
- Deep Learning melhora a detecção de Aβ em exames de imagem.
- ✅ Fato: Modelos como AmyloidPETNet atingem AUC > 0.80 na classificação de Aβ.
- 🔗 An et al. (2024)
🔍 Perspective Research (Visões Diversificadas)
- “AmyloidPETNet: Classificação de Aβ em PET com Deep Learning”(Fan et al., 2024)
- Utiliza redes neurais profundas para classificar positividade de amiloide em imagens PET.
- 🔗 DOI: 10.1148/radiol.231442
- “Algoritmo de Machine Learning para EEG predizer patologia amiloide”(Kim et al., 2023)
- Abordagem inovadora utilizando EEG e aprendizado de máquina para prever positividade Aβ.
- 🔗 DOI: 10.1038/s41598-023-36713-0
- “Deep Learning para detecção de Aβ e Tau”(Lew et al., 2023)
- Avalia a combinação de biomarcadores Aβ, Tau e neurodegeneração em exames de imagem.
- 🔗 DOI: 10.1148/radiol.222441
- “ML para prever positividade amiloide em adultos cognitivamente normais”(Petersen et al., 2022)
- Modelo treinado com dados do estudo A4, focado em detecção precoce.
- 🔗 DOI: 10.1212/WNL.0000000000200553
- “Aprendizado profundo para triagem de Alzheimer com MRI”(Casamitjana et al., 2018)
- Modelos de IA aplicados a imagens de ressonância magnética para predição de AD.
- 🔗 DOI: 10.3233/JAD-180299
📌 Conclusão e Recomendações
Conclusão Geral
Os modelos de aprendizado de máquina demonstram potencial real para a triagem de Alzheimer, reduzindo custo e invasividade.
Recomendações Práticas
- Médicos: Testar a integração de modelos em práticas clínicas.
- Pesquisadores: Melhorar modelos com mais dados e validação externa.
- Empresas: Desenvolver soluções híbridas de IA para diagnóstico médico.
📋 FAQ: Perguntas Frequentes
- Esses modelos podem ser usados na clínica hoje?
Ainda não, mas mostram grande potencial para o futuro. - ApoE4 é obrigatório para previsão da Aβ?
Não, mas melhora a precisão dos modelos.