Kashyap M, Wang X, Panjwani N, et al. Automated Deep Learning–based Detection and Segmentation of Lung Tumors at CT Imaging. Radiology. 2025;314(1):e233029. doi:10.1148/radiol.233029.
📜 Resumo e Questões Estimulantes
Resumo:
Este artigo revisa os avanços no uso de Deep Learning para detecção e segmentação de tumores pulmonares em imagens de tomografia computadorizada (CT). Os modelos baseados em redes neurais convolucionais (CNNs) são explorados, com ênfase em métricas de desempenho, desafios de integração clínica e impacto na melhoria dos desfechos dos pacientes.
Questões Estimulantes
- Como as redes neurais convolucionais estão redefinindo o diagnóstico de tumores pulmonares?
- Quais são os principais obstáculos para a aplicação clínica de sistemas automatizados?
- Como a segmentação automática pode transformar os protocolos de tratamento do câncer pulmonar?
🗝️ Descomplicando os Conceitos Principais
Introdução
O câncer de pulmão é a principal causa de morte por câncer no mundo. A detecção precoce é fundamental para reduzir a mortalidade, e técnicas automatizadas de aprendizado profundo têm mostrado grande potencial na detecção e segmentação de tumores em CT, permitindo diagnósticos mais rápidos e precisos.
Dimensões do Tema
- Deep Learning: As CNNs são amplamente utilizadas na análise de imagens médicas, com resultados promissores em precisão diagnóstica.
- Desafios Clínicos: A necessidade de dados heterogêneos e validação em populações variadas são os principais obstáculos.
- Impacto na Prática Médica: Ferramentas automatizadas podem complementar a expertise dos radiologistas, reduzindo erros e economizando tempo.
Considerações Práticas
| Desafio | Solução |
|---|---|
| Dados Heterogêneos | Aumentar a diversidade de datasets para treinar modelos robustos. |
| Integração Clínica | Desenvolver interfaces amigáveis para suportar a tomada de decisão médica. |
| Acurácia Diagnóstica | Realizar validações multicêntricas para garantir generalização. |
| Complexidade Computacional | Implementar arquiteturas otimizadas para reduzir custos computacionais. |
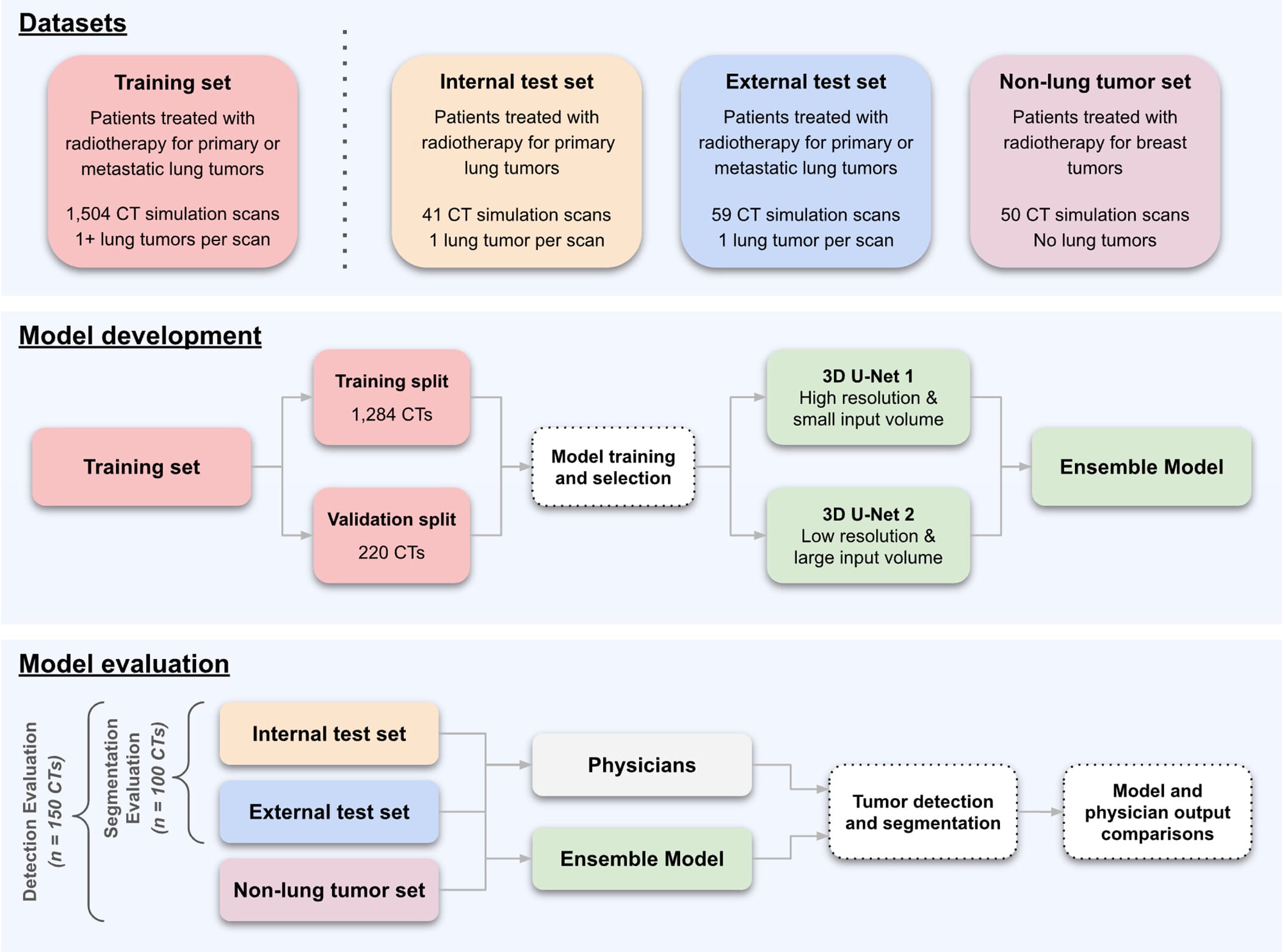
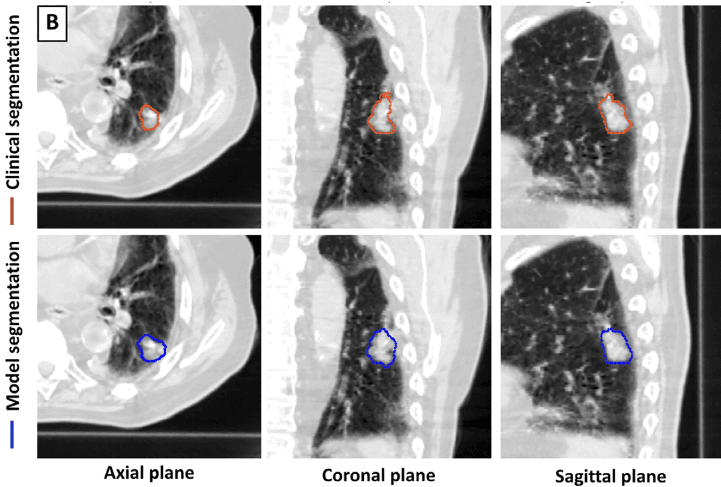
Figuras do artigo:
Direções Futuras
- Validação Multicêntrica: Estudos clínicos amplos para validar o impacto das ferramentas automatizadas na prática médica.
- Radiômica e Aprendizado Profundo: Integração de biomarcadores radiômicos com modelos de aprendizado profundo.
- Automação Completa: Desenvolvimento de sistemas totalmente autônomos para análise de imagens médicas.
🆚 Análise Comparativa com Fontes Externas
| Aspecto | Insights do Artigo | Perspectivas de Fontes Externas |
|---|---|---|
| Redes supervisionadas em 3D | Aplicação em segmentação pulmonar e aumento da precisão. | Dou et al. (2017): Rede supervisionada aprimora a análise volumétrica em imagens médicas. Leia mais |
| Segmentação em cascata | Estratégia híbrida de detecção e segmentação de tumores. | Farag et al. (2017): Segmentação detalhada usando superpixels em cascata. Leia mais |
| Targeting em radioterapia | Integração de IA para planejamento radioterápico automatizado. | Mak et al. (2019): Crowd innovation para targeting mais preciso em radioterapia. Leia mais |
| Detecção e segmentação automática | Implementação de algoritmos híbridos 2D/3D. | Primakov et al. (2022): Plataforma robusta para segmentação em NSCLC. Leia mais |
| Revisão sistemática e Deep Learning | Análise diagnóstico aprimorado de tumores pulmonares. | Venkadesh et al. (2023): Síntese de modelos preditivos e diagnósticos para câncer. Leia mais |
Conclusão e Recomendações
Conclusão Geral
As técnicas de Deep Learning estão revolucionando a detecção e segmentação de tumores pulmonares, oferecendo maior precisão diagnóstica e contribuindo para a personalização do tratamento. No entanto, desafios relacionados à validação clínica permanecem críticos.
Recomendações Práticas
- Ampliar o treinamento clínico para radiologistas utilizarem ferramentas automatizadas com confiança.
- Investir em validação multicêntrica para maior aplicabilidade.
- Explorar integrações com biomarcadores radiômicos para diagnóstico mais abrangente.
📋 FAQ: Perguntas Frequentes
1. Como o Deep Learning melhora o diagnóstico de tumores pulmonares?
R: Ele identifica padrões complexos em imagens CT com alta sensibilidade e especificidade.
2. Essas ferramentas podem substituir radiologistas?
R: Não. Elas complementam a expertise dos radiologistas, otimizando o tempo e reduzindo erros diagnósticos.
3. Quais são os principais desafios para a implementação dessas ferramentas?
R: A necessidade de validação clínica robusta e adaptação a diferentes populações de pacientes.